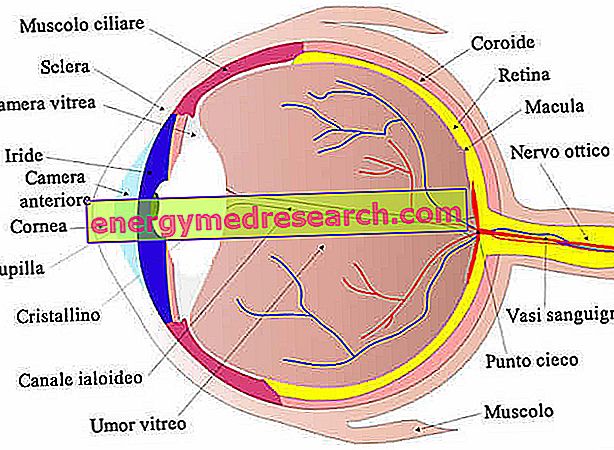
Voidakseen puhua kattavasti hemoglobiinista (Hb) on hyödyllistä käsitellä ensin myoglobiinia (Mb), joka on hyvin samanlainen kuin hemoglobiini, mutta on paljon yksinkertaisempi. Hemoglobiinin ja myoglobiinin välillä on tiukat sukulaisuussuhteet: molemmat ovat konjugoituja proteiineja ja niiden proteesiryhmä (ei-proteiiniosa) on hemiryhmä .
Myoglobiini on globulaarinen proteiini, joka koostuu yhdestä ketjusta, joka koostuu noin sadasta viisikymmentä aminohappoa (organismin mukaan) ja sen molekyylipaino on noin 18 Kd.
Kuten mainittiin, se on varustettu heme-ryhmällä, joka on insertoitu proteiinin hydrofobiseen (tai lipofiiliseen) osaan, joka koostuu taitoksista, jotka johtuvat kuituisten proteiinien a-heliksirakenteista.
Myoglobiini koostuu pääasiassa a-heliksien segmenteistä, jotka ovat läsnä kahdeksassa ja jotka koostuvat lähes yksinomaan polaarisista tähteistä (leusiini, valiini, metioniini ja fenyylialaniini), kun taas polaariset tähteet ovat käytännössä poissa (asparagiinihappo, glutamiinihappo, lysiini ja arginiini); ainoat polaariset tähteet ovat kaksi histidiiniä, joilla on keskeinen rooli hapen hyökkäyksessä heme-ryhmään.
Hem-ryhmä on kromoforiryhmä (imeytyy näkyvään) ja on funktionaalinen ryhmä myoglobiinia.
Katso myös: glykoitu hemoglobiini - hemoglobiini virtsassa
Hieman kemiaa

Protoporfyriinin ja raudan välinen yhteys on tyypillinen ns. Koordinointiyhdisteiden sidos, jotka ovat kemiallisia yhdisteitä, joissa keskiatomi (tai ioni) muodostaa sidoksia muiden kemiallisten lajien kanssa korkeammalla kuin sen hapetusnumero (sähkövaraus). Hemen tapauksessa nämä sidokset ovat palautuvia ja heikkoja.
Raudan koordinointiluku (koordinaatiolinkkien lukumäärä) on kuusi: raudan ympärillä voi olla kuusi molekyyliä, jotka jakavat sidoselektronit.
Koordinointiyhdisteen muodostamiseksi se kestää kaksi orbitaalia oikean suuntaisesti: pystyy "ostamaan" elektroneja ja toinen voi lahjoittaa ne
Hemessä rauta muodostaa neljä tasomaista sidosta neljän typpiatomin kanssa, jotka ovat proto-porfyriinirenkaan keskellä, ja viides sidos proksimaaliseen histidiinityppeen; rautalla on kuudes vapaa koordinaatiolinkki ja se voi sitoutua happeen.
Kun rauta on vapaan ionin muodossa, sen d- tyypin orbitaaleilla on sama energia; myoglobiinissa rauta-ioni sitoutuu protoporfyriiniin ja histidiiniin: nämä lajit häiritsevät magneettisesti raudan orbitaaleja; häiriön laajuus on erilainen eri orbitaaleissa niiden paikkatietoisuuden ja häiritsevien lajien mukaan. Koska kiertoradojen kokonaisenergian on palattava vakiona, häiriö aiheuttaa energianeron eri orbitaalien välillä: joidenkin orbitaalien hankittu energia vastaa toisten menettämää energiaa.
Jos poikkeama, joka tapahtuu orbitaalien välillä, ei ole kovin suuri, on edullista käyttää korkealuokkaista elektronista järjestelyä: sidoselektronit yrittävät järjestää itsensä rinnakkaisiin pyöriin useissa mahdollisissa alitasoissa (maksimi moninaisuus); jos toisaalta häiriö on hyvin vahva ja orbitaalien välillä on suuri erottelu, voi olla helpompaa liittää sidoselektronit alempiin energialähteisiin (matala spin).
Kun rauta sitoutuu happeen, molekyyli ottaa alhaisen spin-aseman, kun taas kun rautassa on kuudes vapaa koordinaatiolinkki, molekyylillä on suuri spin.
Tämän spin-eron ansiosta meoglobiinin spektrianalyysin avulla pystymme ymmärtämään, onko sidottu happi (MbO2) vai ei (Mb).
Myoglobiini on lihaksille tyypillinen proteiini (mutta ei ainoastaan lihaksissa).
Myoglobiini uutetaan siittiösaleesta, jossa sitä esiintyy suurina määrinä ja puhdistetaan sitten.
Valaiden hengitys on ihmisten kaltaista: keuhkojen on imettävä ilmaa hengityselinten läpi; siittiöiden valaan täytyy kuljettaa mahdollisimman paljon happea lihaksissa, jotka kykenevät kertymään happea sitomalla ne niissä olevaan myoglobiiniin; happi vapautuu sitten hitaasti, kun valaiden maku on upotettu, koska sen aineenvaihdunta vaatii happea: mitä enemmän happea, jota siittiövalas pystyy imemään, ja sitä enemmän happea on saatavilla sukelluksen aikana.

Jotta liha olisi enemmän tai vähemmän punainen, se on hemoproteiinien sisältö (se on heme, joka tekee lihasta punaisen).
Hemoglobiinilla on monia rakenteellisia analogeja myoglobiinin kanssa ja se kykenee sitomaan molekyylin happea reversiibelisti; mutta vaikka myoglobiini rajoittuu yleensä lihaksiin ja perifeerisiin kudoksiin, hemoglobiinia esiintyy erytrosyyteissä tai punasoluissa (ne ovat pseudosoluja, eli ne eivät ole todellisia soluja), jotka muodostavat 40 prosenttia verestä.
Hemoglobiini on tetrameter, eli se koostuu neljästä polypeptidiketjusta, joista jokaisella on hemiryhmä ja kaksi kahdella (ihmisessä on kaksi alfa-ketjua ja kaksi beetaketjua).
Hemoglobiinin pääasiallinen tehtävä on hapen kuljetus ; toinen veren funktio, johon hemoglobiini liittyy, on aineiden kuljettaminen kudoksiin.
Reitillä keuhkoista (runsaasti happea) kudoksiin, hemoglobiini kuljettaa happea (samaan aikaan myös muita aineita, jotka pääsevät myös kudoksiin), kun taas käänteisreitillä se kuljettaa kudoksista kerätyt jätteet, erityisesti aineenvaihdunnassa tuotetun hiilidioksidin.
Ihmisen kehityksessä on olemassa geenejä, jotka ilmaistaan vain tietyn ajan; Tästä syystä meillä on erilaiset hemoglobiinit: aikuisen miehen sikiö, alkio.
Niillä ketjuilla, jotka muodostavat nämä erilaiset hemoglobiinit, on erilaiset rakenteet, mutta niiden samankaltaisuudet suorittavat enemmän tai vähemmän.
Selitys useiden eri ketjujen läsnäolosta on seuraava: organismien evoluutioprosessin aikana hemoglobiini on kehittynyt myös erikoistuneena hapen kuljetukseen alueilta, jotka ovat runsaasti puutteellisilla alueilla. Evolutionaarisen ketjun alussa hemoglobiini kantoi happea pienissä organismeissa; evoluution aikana organismit ovat saavuttaneet suurempia ulottuvuuksia, joten hemoglobiini on muuttunut voidakseen kuljettaa happea alueille, jotka ovat kauempana siitä pisteestä, että se oli rikas; tätä varten hemoglobiinia muodostavien ketjujen uudet rakenteet on kodifioitu evoluutioprosessin aikana.
Myoglobiini sitoo happea jopa vaatimattomilla paineilla; perifeerisissä kudoksissa on noin 30 mmHg paine (PO2): tällä paineella myoglobiini ei vapauta happea, joten se olisi tehoton hapen kantajana. Hemoglobiinilla on toisaalta joustavampi käyttäytyminen: se sitoo happea korkealla paineella ja vapauttaa sen, kun paine laskee.
Kun proteiini on toiminnallisesti aktiivinen, se voi hieman muuttaa sen muotoa; esimerkiksi hapetetulla myoglobiinilla on erilainen muoto kuin ei-hapetetussa myoglobiinissa, ja tämä mutaatio ei vaikuta naapureihin.
Diskurssi on erilainen, kun on kyse niihin liittyvistä proteiineista, kuten hemoglobiinista: kun ketju on hapetettu, se indusoituu muuttamaan sen muotoa, mutta tämä modifikaatio on kolmiulotteinen, joten myös muut tetrametrin ketjut vaikuttavat. Se, että ketjut liittyvät toisiinsa, johtaa siihen, että ajatellaan, että yhden muutos vaikuttaa muihin naapureihin, vaikka ne olisivatkin toisistaan poikkeavia; kun ketju on hapetettu, muut tetrametrin ketjut vievät "vähemmän vihamielistä asennetta" happea kohtaan: vaikeus, jolla ketjun hapettimet vähenevät ketjujen vieressä, hapettuvat itseään. Sama argumentti koskee deoxygenationia.
Deoksyhemoglobiinin kvaternääristä rakennetta kutsutaan T (jännitteeksi) muotoksi, kun taas oksyhemoglobiinin nimitystä R- muoto (vapautettu); venytetyssä tilassa on joukko melko voimakkaita sähköstaattisia vuorovaikutuksia happojen aminohappojen ja emäksisten aminohappojen välillä, jotka johtavat deoksyhemoglobiinin jäykkään rakenteeseen (tämän vuoksi "jännittynyt muoto"), kun taas happi on sidottu, näiden kokonaisuus. vuorovaikutus vähenee ("vapautettu muoto"). Lisäksi hapen puuttuessa histidiinimaksu (katso rakenne) stabiloidaan asparagiinihapon vastakkaisella varauksella, kun taas hapen läsnä ollessa on taipumus, että proteiini menettää protonin; kaikki tämä tarkoittaa sitä, että hapetettu hemoglobiini on vahvempi happo kuin hapettomalla hemoglobialla: bohr-vaikutus .
PH-arvosta riippuen hemiryhmä sitoutuu enemmän tai vähemmän helposti happeen: happamassa ympäristössä hemoglobiini vapauttaa happea helpommin (jännittynyt muoto on vakaa), kun taas perusympäristössä sidos happeen on vahvempi.

Jokainen hemoglobiini vapauttaa 0, 7 protonia per tuleva mooli happea (O2).
Bohr-vaikutus sallii hemoglobiinin parantavan sen kykyä kuljettaa happea.
Hemoglobiinin, joka tekee matkan keuhkoista kudoksiin, on tasapainotettava paineen, pH: n ja lämpötilan mukaan.
Näemme lämpötilan vaikutusta .
Keuhkoalveolien lämpötila on noin 1-1, 5 ° C alempi kuin ulkolämpötila, kun taas lihaksissa lämpötila on noin 36, 5-37 ° C; lämpötilan noustessa kyllästystekijä pienenee (samalla paineella): tämä johtuu siitä, että kineettinen energia kasvaa ja dissosioituminen suosii.

On muitakin tekijöitä, jotka voivat vaikuttaa hemoglobiinin kykyyn sitoutua happeen, joista toinen on 2, 3-bisfosflylyseraatin pitoisuus .
2, 3-bisfosoglyseraatti on metabolinen aine, jota esiintyy erytrosyyteissä pitoisuutena 4-5 mM (ei missään muussa kehon osassa ole läsnä niin suurina pitoisuuksina).
Fysiologisessa pH: ssa 2, 3-bisfosoglyseraatti deprotonoidaan ja sillä on viisi negatiivista varausta; se menee kiilaan hemoglobiinin kahden beeta-ketjun välillä, koska näillä ketjuilla on suuri positiivisten varausten pitoisuus. Beeta-ketjujen ja bisfosflylyseraattiketjujen väliset sähköstaattiset vuorovaikutukset antavat järjestelmälle tiettyä jäykkyyttä: saadaan jännittynyt rakenne, jolla on vähän affiniteettia happea kohtaan; hapetuksen aikana poistetaan sitten 2, 3-bisfos- glyseraatti.
Erytrosyytteissä on erityinen laite, joka muuntaa 1, 3-bisfosoglyseraatin (joka on tuotettu aineenvaihdunnasta) 2, 3-bisfosflylyseraatiksi siten, että se saavuttaa 4-5 mM: n pitoisuuden ja siksi hemoglobiini pystyy vaihtamaan l happea kudoksissa.
Kudokseen saapuva hemoglobiini on vapautuneessa tilassa (sitoutunut happeen), mutta kudoksen läheisyydessä se karboksyloidaan ja kulkee venytettyyn tilaan: tässä tilassa olevalla proteiinilla on pienempi taipumus sitoutua happeen, verrattuna vapautuneeseen tilaan, hemoglobiini vapauttaa happea kudokseen; lisäksi veden ja hiilidioksidin välisen reaktion vuoksi tuotetaan H + -ioneja, joten bohr-vaikutuksesta johtuen lisää happea.
Hiilidioksidi diffundoituu plasman kalvon läpi kulkevaan erytrosyyttiin; kun otetaan huomioon, että erytrosyytit muodostavat noin 40% verestä, meidän pitäisi odottaa, että vain 40% kudoksista diffundoituvasta hiilidioksidista tulee niihin, todellisuudessa 90% hiilidioksidista pääsee punasoluihin, koska ne sisältävät entsyymin, joka muuntaa hiilidioksidi hiilihapossa, tästä seuraa, että hiilidioksidin kiinteä pitoisuus erytrosyytteissä on alhainen ja siksi pääsynopeus on korkea.

Toinen ilmiö, joka ilmenee, kun erytrosyytti saavuttaa kudoksen, on seuraava: gradientilla HCO3- (hiilidioksidijohdannainen) tulee ulos erytrosyytistä ja tasapainottamaan negatiivisen varauksen poistuminen meillä on kloorien tulo, joka määrittää osmoottisen paineen nousun: tämän vaihtelun tasapainottamiseksi on myös vettä, joka aiheuttaa erytrosyyttien turvotusta (HAMBURGER-vaikutus). Päinvastainen ilmiö ilmenee, kun erytrosyytti saavuttaa keuhkojen alveolit: erytrosyyttien deflaatio tapahtuu (HALDANE-vaikutus). Siten laskimot erytrosyytit (suoraan keuhkoihin) ovat pyöreämpiä kuin valtimo.