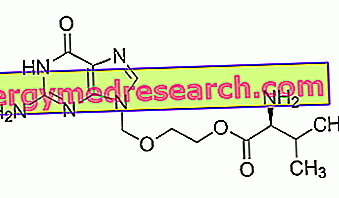
Mikä on Xolair?
Xolair on lääke, joka sisältää vaikuttavana aineena omalizumabia. Se on saatavana kahdessa muodossa: injektiopullo, jossa on jauhe ja liuotin, joka muodostaa injektionesteen; esitäytetty ruisku, joka sisältää injektionestettä. Jokainen injektiopullo ja jokainen ruisku sisältävät 75 tai 150 mg omalizumabia.
Mihin Xolairia käytetään?
Xolair on tarkoitettu parantamaan allergian aiheuttamaa vakavan pysyvän astman hallintaa. Sitä käytetään astman hoitoon kuuden vuoden ikäisillä potilailla.
Kaikkien Xolair-hoitoa saavien potilaiden on täytettävä seuraavat kriteerit:
- ovat saaneet positiivisen tuloksen ihon testissä ilmassa esiintyvän allergeenin (aine, joka aiheuttaa allergiaa) aiheuttamasta allergiasta, kuten kotilinnoista, siitepölystä tai homeesta,
- jos sinulla on usein päivittäisiä oireita tai \ t
- on pitänyt olla toistuvia vakavia astman pahenemisvaiheita (akuutti astma, joka vaatii pelastavien lääkkeiden käyttöä yhdessä muiden lääkkeiden kanssa) huolimatta suurista annoksista inhalaatioisilla kortikosteroideilla sekä pitkällä beta2-agonistilla hengitettynä.
12-vuotiaiden ja vanhempien potilaiden keuhkotoiminnan on oltava myös vähäisempi (alle 80% verrattuna normiin).
Kaikenikäisille potilaille Xolair-hoitoa tulisi harkita vain silloin, kun astmaa aiheuttaa immunoglobuliini E (IgE).
Lääkettä saa vain reseptillä .
Miten Xolairia käytetään?
Xolair-hoidon saa aloittaa lääkäri, jolla on kokemusta vakavan pysyvän astman hoidosta.
Ennen Xolairin antamista lääkärin on mitattava IgE-taso potilaan veressä. Potilaat, joilla on alhainen IgE-taso, eivät todennäköisesti hyöty lääkkeestä. Xolair-hoidon saa antaa terveydenhuollon ammattilainen (lääkäri tai sairaanhoitaja) ihonalaisena injektiona (ihon alle), olkapäähän tai reiteen, kahden tai neljän viikon välein. Xolairin annos ja sen esiintymistiheys riippuvat IgE-pitoisuudesta veressä ja kehon painossa. Yleensä annos on 75 - 375 mg yhdestä kolmeen injektioon; suurin suositeltu annos on
375 mg kahden viikon välein. Yleensä Xolairilla on 12–16 viikkoa aikaa hyötyä. Lisätietoja on EPAR-lausunnon sisältämässä valmisteyhteenvedossa.
Miten Xolair vaikuttaa?
Xolairin vaikuttava aine omalizumabi on monoklonaalinen vasta-aine. Monoklonaalinen vasta-aine on vasta-aine (proteiinityyppi), joka on suunniteltu tunnistamaan ja sitoutumaan spesifiseen rakenteeseen (antigeeniin) kehossa. Omalitsumabi suunniteltiin sitoutumaan ihmisen IgE: hen, joka tuotetaan suurina määrinä allergisille potilaille ja joka aiheuttaa allergisen reaktion allergeenille. Sitoutumalla IgE: hen omalizumabi "imee" veressä liikkuvaa vapaata IgE: tä. Tämä tarkoittaa, että kun elimistö kohtaa allergeenin, on saatavilla vähemmän IgE: tä, joka voi aiheuttaa allergisen reaktion. Tämä vähentää allergiaoireita, kuten astmakohtauksia.
Miten Xolairia on tutkittu?
Xolairia on tutkittu 12-vuotiailla ja sitä vanhemmilla allergisilla astma-potilailla viidessä päätutkimuksessa, joihin osallistui 2 299 potilasta, mukaan lukien tutkimus 482 potilaasta, jotka kärsivät vakavasta allergisesta astmasta, joita ei hoidettu perinteisillä hoidoilla. Sitä on tutkittu myös 627: llä 6–12-vuotiaalla lapsella.
Kaikissa tutkimuksissa Xolairia verrattiin lumelääkkeeseen, jota käytettiin potilaan jatkuvan hoidon lisähoitona. Tehokkuuden pääasialliset indikaattorit olivat pahenemisvaiheiden lukumäärä, astman pahenemisesta kärsivien potilaiden määrä, potilaiden elämänlaatu (arvioitu vakiomuotoisten kyselylomakkeiden perusteella) ja potilaan astman hoitoon tarvittavan kortikosteroidin määrä .
Mitä hyötyä Xolairista on havaittu tutkimuksissa?
12-vuotiailla ja sitä vanhemmilla potilailla Xolair pienensi pahenemisten määrää noin puolella. Ensimmäisissä kolmessa tutkimuksessa Xolair-ryhmässä havaittiin ensimmäisten 28 tai 52 hoitoviikon aikana noin 0, 5 pahenemista vuodessa, kun lumeryhmässä oli yksi vuosi. Lisäksi harvemmilla Xolairilla hoidetuilla potilailla esiintyi pahenemista kuin lumelääkettä saaneilla potilailla. Niistä havaittiin myös parempaa elämänlaatua ja flutikasonin (kortikosteroidi) käyttöä. Xolairin vaikutukset ovat olleet tehokkaampia potilailla, joilla on vaikea astma. Vaikeaa allergista astmaa sairastaville potilaille tehdyssä tutkimuksessa ei havaittu eroa Xolairin tai lumelääkkeen pahenemisvaiheiden määrästä, vaikka Xolair aiheutti samanlaisen vähenemisen aikaisemmissa tutkimuksissa havaittujen pahenemisten lukumäärässä.
Tutkimuksessa, jossa tutkittiin 6–12-vuotiaita lapsia, pahenemisten määrä oli pienempi Xolairia saaneilla. Niistä 235 lapsesta, joita hoidettiin ennen tutkimuksen aloittamista suurilla annoksilla inhalaatiokortikosteroideja pitkäaikaisen beeta2-agonistin lisäksi hengitettynä, Xolair-hoidon ensimmäisten 24 viikon aikana oli keskimäärin 0, 4 pahenemista, verrattuna 0, 6: een lumelääkettä saaneilla lapsilla.
Mitä riskejä Xolairiin liittyy?
Xolairin yleisimmät sivuvaikutukset 12-vuotiailla ja sitä vanhemmilla potilailla (1–10 potilaalla sadasta) ovat päänsärky ja reaktiot pistoskohdassa, mukaan lukien turvotus, punoitus, kipu ja kutina. 6–12-vuotiailla lapsilla yleisimmät haittavaikutukset (yli yhdellä 10 potilaasta) ovat päänsärky ja pyrexia (kuume). Pakkausselosteessa on luettelo kaikista Xolairin ilmoitetuista sivuvaikutuksista.
Xolairia ei pidä antaa potilaille, jotka voivat olla yliherkkiä (allergisia) omalizumabille tai muille lääkkeen sisältämille aineille.
Miksi Xolair on hyväksytty?
Lääkevalmistekomitea (CHMP) katsoi, että yleisesti ottaen Xolairin tutkimuksissa on saatu aikaan tuloksia, jotka osoittavat sen tehokkuuden vakavan allergisen astman hoidossa. Sen vuoksi komitea päätti, että Xolairin hyödyt ovat sen riskejä suuremmat kuin lisähoito astman hallinnan parantamiseksi yli 6-vuotiailla potilailla, joilla on pysyvä vakava allerginen astma. Komitea suositteli myyntiluvan myöntämistä Xolairille.
Lisätietoja Xolairista
Euroopan komissio antoi 25. lokakuuta 2005 Novartis Europharm Limitedille koko Euroopan unionin alueella voimassa olevan Xolairin myyntiluvan.
Xolairia koskeva EPAR-arviointilausunto on kokonaisuudessaan tässä.
Tämän yhteenvedon viimeisin päivitys: 07-2009.