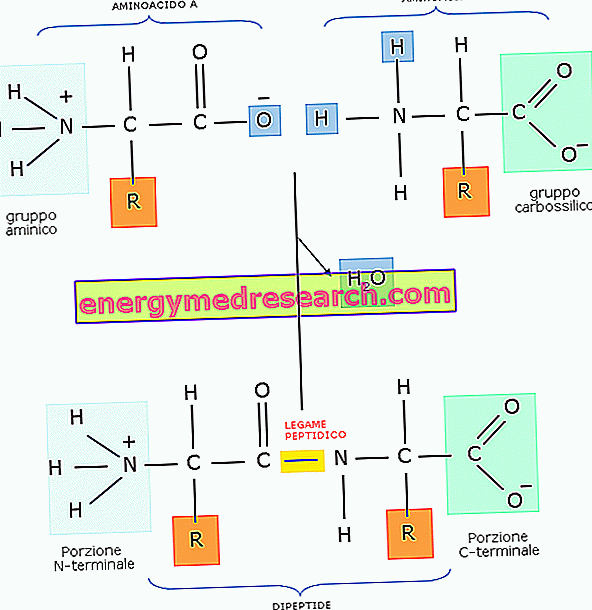
Peptidisidos on kovalenttinen sidos, joka muodostuu kahden molekyylin välille, kun yhden karboksyyliryhmä reagoi toisen aminoryhmän kanssa kondensaatioreaktion (tai dehydratoinnin, joka johtaa - ts. Vesimolekyylin eliminointiin) kautta. ).
Yleensä peptidisidos muodostuu kahden aminohapon välillä, jotka ovat peräisin dipeptidistä.
Koska sen molekyylissä dipeptidi käsittää edelleen aminoryhmän ja karboksyyliryhmän, se voi muodostaa peptidisidoksen kolmannen aminohapon kanssa, joka on peräisin tripeptidistä, ja niin edelleen. Kun aminohappojen määrä on suhteellisen pieni, sitä kutsutaan oligopeptidiksi, kun taas jos aminohappojen määrä kasvaa, sitä kutsutaan polypeptidiksi tai proteiiniksi.
Todellisuudessa kuviosta huolimatta peptidisidos ei ole yksinkertainen, mutta se edustaa 60%: n yksittäistä liimausluokkaa ja 40%: n kaksoissidosluonnon.
Elävissä organismeissa peptidisidoksen muodostumista katalysoi entsyymi, jota kutsutaan peptidyylitransferaasiksi - joka esiintyy ribosomien suuressa alayksikössä.
Jopa ruokavalioon lisätyt proteiinit koostuvat aminohappoketjuista, jotka ovat liittyneet peptidisidoksisiin. Ruoansulatusprosessin aikana nämä sidokset rikkoutuvat tiettyihin mahalaukun ja haiman mehuihin sisältyviin entsyymeihin (peptidaaseihin). Yksittäiset aminohapot, jotka imeytyvät suolistossa, kulkevat verestä ja ne kerääntyvät solujen - ennen kaikkea maksan - kautta, jotka yhdistävät ne uusilla peptidisidoksilla tarvitsemiensa proteiinien muodostamiseksi (ei ainoastaan rakenteellisia, vaan myös hormonaalisia, entsymaattisia jne.). .). Luonnossa on itse asiassa suuri määrä proteiineja, joilla on erilaiset fysikaalis-kemialliset ominaisuudet, jotka johtuvat 20 tavallisen aminohapon erilaisista ominaisuuksista ja siitä, miten ne yhdistetään polypeptidiketjuun. Riittää, kun sanotaan, että 100 aminohapon proteiini, siis suhteellisen pieni, voi koostua 20100 = 1, 27 x 10130 mahdollisista polypeptidiketjuista. Ohjeita oikean aminohappoketjun rakentamiseksi on suljettu yksilön genomiin.



