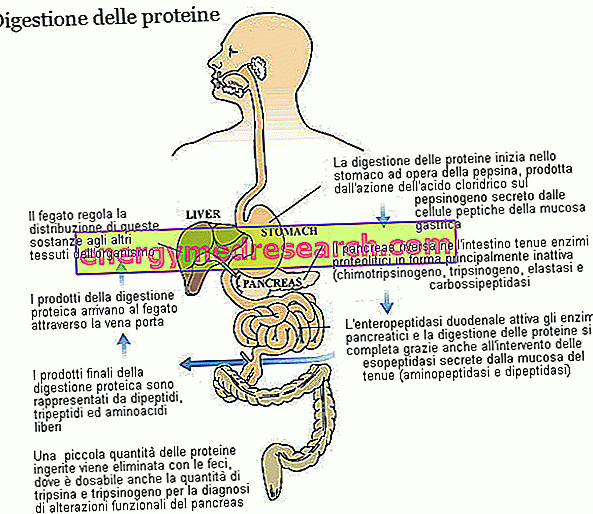
Trypsiini ja kymotrypsiini ovat kaksi tärkeintä entsyymiä ravintoproteiinien pilkkomisessa. Molemmat tuotetaan ja erittyvät zymogeeneiksi, eli inaktiivisessa muodossa, haiman; trypsiinin zymogeeniprekursoria kutsutaan trypsi- geeniksi, kun taas kymotrypsiiniä kutsutaan kymotrypsinogeeniksi.
Trypsiini ja kymotrypsiini kuuluvat proteolyyttisten entsyymien suureen perheeseen (osallistuu proteiinien pilkkomiseen) ja endopeptidaasialaryhmään. Nämä aineet - mukaan lukien mahan pepsiini ja haiman elastaasi - hyökkäävät peptidisidoksia aminohappoketjussa, jolloin syntyy pienempiä molekyylifragmentteja. Toiseen ryhmään kuuluvat exymeptidaasien entsyymit täydentävät trypsiinin ja kymotrypsiinin työtä, irrottaen yksittäiset aminohapot peptidiketjun päistä; Haiman karboksipeptidaasit (A1, A2 ja B, jotka hyökkäävät karboksyylipäähän) kuuluvat tähän perheeseen, mutta myös aminopeptidaasit (jotka hyökkäävät aminoterminaalista päätä) ja dipeptidaasit, jotka tuotetaan ja erittyvät ohutsuolen limakalvolla. Jotkin karboksipeptidaasit, jotka ovat samanlaisia kuin trypsiiniä (trypsi- geeniä) ja kymotrypsiiniä (kymotrypsinogeeniä), erittävät haima inaktiivisessa muodossa. Kaikissa kolmessa tapauksessa entsymaattiseen aktivointiprosessiin osallistuva entsyymi on enteropeptidaasi, duodenaalisen limakalvon solujen tuottama ja erittämä proteiini; tarkemmin sanottuna enteropeptidaasi on spesifinen trypsi- geenille, joka kerran muuttunut trypsiiniksi aktivoi myös muita proteolyyttisiä entsyymejä, mukaan lukien trypsi- geeni itse.
Trypsiinin ja kymotrypsiinin väliset toiminnalliset erot koskevat pelkästään niiden spesifisyyttä, eli kyky tunnistaa ja hajottaa vain hyvin määriteltyjen aminohappojen muodostamat sidokset. Trypsiini puuttuu pääasiassa peptidisidoksiin, jotka sitoutuvat emäksisiin aminohappoihin (kuten arginiiniin ja lysiiniin), kun taas kymotrypsiini hydrolysoi pääasiassa tyrosiinia, fenyylialaniinia, tryptofaania, leusiinia ja metioniinia sisältäviä sidoksia.
Eri proteolyyttisten entsyymien ansiosta mahalaukun happamuuden myötä hajoavat proteiinit, jotka alun perin muodostivat useita kymmeniä aminohappoja, hajoavat dipeptideiksi, tripeptideiksi ja vapaiksi aminohappoiksi. kuljetetaan maksaan.
Trypsiini ja kymotrypsiini ulosteissa
Kymotrypsiinin ja trypsiinin määrittämistä ulosteissa käytetään ja se oli erityisesti niin aikaisemmin eksokriinisen haiman toiminnallisen kapasiteetin epäsuorana testinä. Jos jokin ei toimi kunnolla tässä rauhasen tasolla, on loogista odottaa, että trypsiinin ja kymotrypsiinin synteesi on vähentynyt, mikä on myös puutteellinen ulosteessa. Testillä on hyvä herkkyys, mutta sitä rasittaa väärien positiivisten ja väärien negatiivisten riskien todellinen riski. Laksatiivien käyttö esimerkiksi vähentää entsyymien pitoisuutta ulosteen materiaalissa, kun taas ruoansulatuskanavan uutteet (kuten pankreatiini) tai vihannekset (esim. Ananasvarsi, papaija, papaiini ja bromelaiini) aiheuttavat vääriä negatiivisia tuloksia. Myös suoliston bakteerifloorat vaikuttavat hieman trypsiinin ja kymotrypsiinin määrään, joka tulee ulosteeseen muuttumattomana; tästä syystä antibioottien käyttö voi aiheuttaa vääriä negatiivisia vaikutuksia; päinvastoin, divertikuloosin ja muiden bakteerien lisääntymistä suosivien tilojen läsnä ollessa voidaan tallentaa vääriä positiivisia tuloksia.
Tyypillinen trypsiinin ja kymotrypsiinin annostelu ulosteessa on haiman vajaatoiminnan havaitseminen potilailla, joilla on kystinen fibroosi. Yksi tämän taudin seurauksista on trypsiinin ja muiden ruoansulatusentsyymien normaalin kuljetuksen heikentyminen haimasta pohjukaissuoleen; tästä syystä synnytyksen aikana lapsen, jolla on kystinen fibroosi, ulosteet ovat erityisen kompakteja, mikä aiheuttaa suoliston tukkeutumisen. Tämän seurauksena mekoniumiin kirjataan erityisen pieniä määriä kymotrypsiiniä ja trypsiiniä.