proteiineja
Proteiinit ovat polymeerisiä molekyylejä, jotka koostuvat yli 100 aminohaposta, jotka on sitoutunut peptidisidoksilla (lyhyempiä aminohappoketjuja kutsutaan polypeptideiksi tai peptideiksi); proteiinien rakenne voi olla enemmän tai vähemmän pitkä, taitettu takaisin itselleen ja kiinnitetty muihin molekyyleihin (tekijät, jotka määrittävät sen monimutkaisuuden ja luonnehtivat sen biologisen toiminnan). Nämä rakenteet voidaan luokitella: primaarirakenteeseen, sekundääriseen rakenteeseen (α-helix ja β-esite), tertiääriseen rakenteeseen ja kvaternääriseen rakenteeseen.

Proteiinitoiminnot
Luonnossa proteiinit suorittavat monia toimintoja ja tunnetuin on epäilemättä rakenteellinen; Ajattele vain, että jokainen organismin kudosmatriisi perustuu peptidien muodostamaan luurankoon tai polymeeriseen mosaiikkiin (esim. lihaskuidut, luumatriisi, sidekudos ja tietystä näkökulmasta jopa veri).
Vähemmän tärkeä on bio-säätelyn ja kemiallisen / hormonaalisen sovittelun tehtävä, itse asiassa proteiinit ovat molempien entsyymien ja monien hormonien perusaineosia.
Veressä proteiineilla on myös erittäin tärkeä kuljetustoiminto; tämä koskee hemoglobiinia (hapen kuljetus), transferriiniä (raudan kuljetus), albumiinia (lipidimolekyylien kuljetus) jne.
Silti verenkierron virrassa proteiinit ovat käyttökelpoisia immuunipuolustuksena; ne muodostavat ANTICORPI: n, oleellisia molekyylejä, joita tuottavat lymfosyytit, jotka ovat hyödyllisiä organismin vasteessa patogeenejä vastaan.
Lopuksi proteiineja - mutta tarkemmin sanottuna aminohappoja - voidaan käyttää energiankäyttöön maksan neoglukogeneesin avulla ja antaa 4 kilokaloria (kcal) grammaa kohti. On melko monimutkainen prosessi, joka mahdollistaa transaminaation ja deaminoinnin avulla glukoosin tuottamisen hypoglykemiaolosuhteissa (mahdollisesti aiheuttama paasto, erityisesti voimakas ja / tai pitkittynyt lihasvoima, patologiset tilat tai haitalliset kliiniset olosuhteet jne.). Jotkin neoglukogeeniset aminohapot voivat olla myös ketogeenisiä, joten niiden konversio määrää happomolekyylien vapautumisen ketonirunkoiksi.
Huom. Proteiinien energiatehokkuuden tulisi olla marginaalinen ja alempi kuin sokerien ja rasvojen.
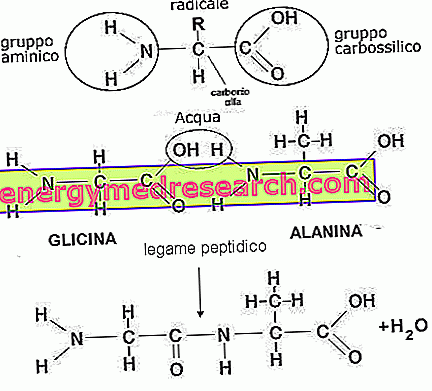
Aminohapot
Aminohapot ovat kvaternaarisia molekyylejä, jotka koostuvat hiilestä, vedystä, hapesta ja typestä. Yli 500 tyyppiä tunnetaan ja niiden yhdistelmä erottaa lukemattomat peptidimuodot. Tavalliset, L-aminohapot, ovat 20: alaniini, arginiini, asparagiini, asparagiinihappo, kysteiini, glutamiinihappo, glutamiini, glysiini, histidiini, isoleusiini, leusiini, lysiini, metioniini, fenyylialaniini, proliini, seriini, treoniini, tryptofaani, tyriini ja valiini . Jälkimmäisen aineenvaihdunnasta on mahdollista saada laaja valikoima tavanomaisia tai satunnaisia aminohappoja, jotka muodostavat pääasiassa hormoneja, entsyymejä tai välimolekyylejä (karnitiini, homokysteiini, kreatiini, tauriini jne.).
Tavallisista aminohapoista osa organismeista ei voi syntetisoida, ja niitä kutsutaan ESSENTIALiksi; aikuiselle ihmiselle on 9: fenyylialaniini, leusiini, isoleusiini, lysiini, metioniini, treoniini, tryptofaani ja valiini . Lapsissa on kaikkiaan 11; lisätään histidiini ja arginiini .
Muita aminohappojen luokituksia ovat: niiden sivuketjujen polaarisuus (neutraali apolaarinen, polaarinen neutraali, happolataus, emäksiset varaukset) tai radikaaliryhmän tyyppi (hydrofobinen, hydrofiilinen, happo, emäksinen, aromaattinen).
Haarautuneen ketjun aminohapot
Keskeisimpien joukossa on myös kolme haaraketjuista aminohappoa (BCAA): leusiini, isoleusiini ja valiini ; erityispiirteenä, joka erottaa haarautuneen ketjun aminohapot toisilta, edustaa erilainen energiantuotannon metabolinen polku.
Kuten jo selitettiin, transaminaation deaminoinnin jälkeen useimmat aminohapot voidaan kohdistaa neoglukogeneesiin ja päästä Krebs-sykliin oksalasetaatin tai pyruvaatin muodossa. Loppujen lopuksi, jos olisi todellista tarvetta, jotkin verenkierron virrassa olevista aminohapoista pääsevät maksa-hepatosyytteihin ja poistuvat glukoosina; tämä ei ole haarautuneiden aminohappojen tapauksessa. Verrattuna muihin, BCAA: t ovat suoraan käyttökelpoisia molekyylejä lihaksista, ja tämä erityispiirre tekee niistä paljon tehokkaampia suorassa energiantuotannossa ja muuntamisessa glykogeenivarastojen palauttamiseksi; on sanomattakin selvää, että jos organismi on riittävästi syötetty, haarautuneiden aminohappojen katabolia edustaa lähes merkityksetöntä neoglukogeenista osaa; Glukoosi pysyy AINA ensisijaisena energialähteenä, joten glykemian ja SUFICIENT-glykogeenivarastojen olosuhteissa ei ole mitään syytä pelätä, että lihas tarvitsee haaroittuneiden aminohappojen ylijäämän normaalin urheilullisen suorituskyvyn aikana.



