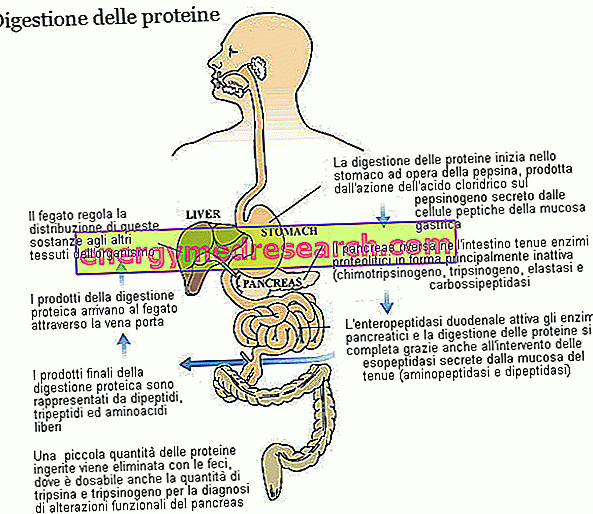
Mitä Lartruvo - Olaratumabia käytetään ja mihin sitä käytetään?
Lartruvo on syöpälääke, jota käytetään aikuisten, joilla on kehittynyt pehmytkudosarkooma, hoitoon, joka vaikuttaa kehon pehmeisiin tukikudoksiin, kuten lihaksiin, verisuoniin ja rasvakudokseen. Lartruvoa käytetään yhdessä doksorubisiinin (toinen syöpälääke) kanssa potilailla, joille ei voida tehdä leikkausta tai sädehoitoa (säteilyhoitoa) ja joita ei ole aiemmin hoidettu doksorubisiinilla.
Koska pehmytkudosarkoomaa sairastavien potilaiden määrä on alhainen, tautia pidetään "harvinaisena" ja Lartruvoa pidettiin "harvinaislääkkeenä" (harvinaisissa sairauksissa käytetty lääke) 12. helmikuuta 2015.
Miten Lartruvo - Olaratumabia käytetään?
Juuri voidaan hankkia vain reseptillä. Hoito on aloitettava ja valvottava lääkärillä, jolla on kokemusta syövän hoidosta.
Lartruvo on saatavana infuusioliuoksena (tiputuksena) laskimoon. Infuusion aikana potilaita on seurattava infuusioon liittyvien reaktioiden oireiden varalta, ja koulutetun henkilökunnan ja hätärasvatuslaitteiden tulee olla saatavilla.
Lartruvon suositeltu annos on 15 mg painokiloa kohti kahdesti kolmen viikon ajan päivinä 1 ja 8. Nämä kolmen viikon syklit tulee toistaa, kunnes tauti pahenee tai haittavaikutukset eivät ole tulla hyväksymättömäksi. Lartruvoa annetaan yhdessä doksorubisiinin kanssa korkeintaan 8 hoitosykliin, jota seuraa Lartruvo yksinään potilailla, joiden sairaus ei ole heikentynyt. Doksorubisiinia annetaan kunkin syklin 1. päivänä Lartruvon infuusion jälkeen.
Lisätietoja on pakkausselosteessa.
Miten Lartruvo - Olaratumab toimii?
Lartruvon vaikuttava aine, olaratumabi, on monoklonaalinen vasta-aine (proteiinityyppi), joka on suunniteltu tunnistamaan ja sitoutumaan proteiiniin, joka on nimeltään "verihiutaleista peräisin oleva kasvutekijä-reseptori-a" (PDGFRa). Tämä proteiini löytyy usein solujen pinnasta, jossa sillä on rooli solujen lisääntymisen säätelyssä. Kasvaimissa, kuten pehmytkudoksen sarkoomassa, tämä proteiini on läsnä korkealla tasolla tai on yliaktiivinen, mikä saa solut syöpymään. Sitoutumalla PDGFRa: een sarkoomasoluissa Lartruvo: n tulisi estää sen aktiivisuus ja siten hidastaa kasvaimen kasvua.
Mitä hyötyä Lartruvo - Olaratumabista on havaittu tutkimuksissa?
Lartruvoa tutkittiin pääasiassa tehdyssä tutkimuksessa, johon osallistui 133 aikuista, joilla oli pitkälle edennyt pehmytkudosarkooma ja joita ei voitu leikata tai sädehoitoa ja joita ei aiemmin hoidettu antrasykliinillä (ryhmä syöpälääkkeitä, jotka sisälsivät doksorubisiinia). ). Tutkimuksessa kävi ilmi, että Lartruvo yhdessä doksorubisiinin kanssa oli tehokkaampi kuin doksorubisiini pelkästään ajan pidentämisen aikana, jolloin potilaat elivät ilman sairauden pahenemista (etenemistä ilman eloonjäämistä). Lartruvo + -doksorubisiinilla hoidetut potilaat elivät keskimäärin 6, 6 kuukautta ilman taudin pahenemista, kun taas pelkkää doksorubisiinia saaneiden potilaiden määrä oli 4, 1 kuukautta. Lisäksi Lartruvon ja doksorubisiinin yhdistelmällä hoidetut potilaat kokivat lähes kaksinkertaisen doksorubisiinilla hoidettujen potilaiden määrän (26, 5 verrattuna vastaavasti 14, 7 kuukauteen).
Mitä riskejä Lartruvo - Olaratumabiin liittyy?
Lartruvon yleisimmät sivuvaikutukset (jotka saattavat vaikuttaa useampaan kuin yhteen 10 potilaasta) ovat pahoinvointi, tuki- ja liikuntaelinten kipu (luu- ja lihaskipu), neutropenia (neutrofiilien alhainen määrä, infektioita torjuva valkosolujen tyyppi) ja mukosiitti. (organismin kostean pinnan tulehdus, joka vaikuttaa yleisimmin suuhun ja kurkkuun). Yleisimpiä haittavaikutuksia, jotka johtivat hoidon lopettamiseen, olivat infuusioon liittyvät reaktiot (allergiset reaktiot, jotka voivat olla vakavia, oireet, kuten vilunväristykset, kuume ja hengitysvaikeudet) ja mukosiitti. Vakavimpia haittavaikutuksia olivat neutropenia ja tuki- ja liikuntaelinten kipu.
Pakkausselosteessa on luettelo kaikista Lartruvon ilmoitetuista rajoituksista ja kaikista haittavaikutuksista.
Miksi Lartruvo - Olaratumab on hyväksytty?
Päätutkimuksessa saadut tiedot osoittavat, että Lartruvo yhdessä doksorubisiinin kanssa parantaa sekä progressiivista että yleistä eloonjäämistä potilailla, joilla on edennyt pehmytkudosarkooma. Päätutkimukseen osallistuneiden potilaiden vähäisen määrän vuoksi lääkettä markkinoivan yrityksen on annettava lisätietoja. Lartruvoa ja doksorubisiinia saaneilla potilailla havaittiin haittavaikutusten lisääntymistä, kun otetaan huomioon lääkkeen turvallisuusprofiili. hoidon etujen vuoksi sivuvaikutuksia pidettiin siedettävinä ja hallittavina.
Viraston ihmisille tarkoitettuja lääkkeitä käsittelevä komitea (CHMP) päätti siksi, että Lartruvon hyödyt ovat sen riskejä suuremmat ja suositteli sen hyväksymistä EU: ssa.
Lartruvo on saanut "ehdollisen hyväksynnän". Tämä tarkoittaa sitä, että lisää tietoa lääkkeestä, jota yhtiön on annettava, on saatavilla tulevaisuudessa. Euroopan lääkevirasto tarkistaa vuosittain saatavilla olevat uudet tiedot ja tämä yhteenveto päivitetään vastaavasti.
Mitä tietoja Lartruvolta vielä odotetaan?
Koska Lartruvolle on myönnetty ehdollinen hyväksyntä, Lartruvoa markkinoiva yritys toimittaa lisää tietoja meneillään olevasta tutkimuksesta lääkkeen tehokkuuden ja turvallisuuden vahvistamiseksi.
Mitä toimenpiteitä toteutetaan Lartruvo - Olaratumabin turvallisen ja tehokkaan käytön varmistamiseksi?
Suositukset ja varotoimet, joita terveydenhuollon ammattilaisille ja potilaille on noudatettava, jotta Lartruvoa voidaan käyttää turvallisesti ja tehokkaasti, on sisällytetty valmisteyhteenvetoon ja pakkausselosteeseen.
Lisätietoja Lartruvosta - Olaratumabista
EPAR-arviointikertomuksen täydelliset versiot ja Lartruvon riskienhallintasuunnitelman yhteenveto löytyvät viraston verkkosivustosta: ema.europa.eu/Find medicine / Ihmislääkkeet / Euroopan julkiset arviointiraportit. Lisätietoja Lartruvo-hoidosta saat pakkausselosteesta (joka on myös osa EPARia) tai ota yhteys lääkäriisi tai apteekkiin.
Harvinaislääkkeitä käsittelevän komitean Lartruvoon liittyvän lausunnon yhteenveto on saatavilla viraston verkkosivuilla: ema.europa.eu/Find medicine / Ihmislääkkeet / Harvinaiset sairaudet.