morfologia
Makroskooppisella tasolla Alzheimerin taudissa voidaan havaita vaihtelevaa kortikaalista atrofiaa (kudos- tai elinmassan vähenemistä), jolle on tunnusomaista parietaalisten aukkojen laajentuminen, jotka ovat entistä korostuneempia etu-, ajallisissa ja parietaalisissa lohkoissa. Tätä atrofiaa kompensoi kammiononteloiden laajeneminen, joka on sekundaarinen parenkyymin häviämisen vuoksi (kuvio 1). Erityisesti sairauden edistyneissä vaiheissa mediaalisen temporaalisen lohen rakenteet, mukaan lukien hippokampus, entorinaalinen kuori ja amygdala, atrofia vakavasti, kun otetaan huomioon niiden osallistuminen patologian varhaisista vaiheista.
Lisäksi Alzheimerin taudissa esiintyy myös mikroskooppisia muutoksia, jotka tunnetaan solunulkoisina syllisinä plakkeina ja solunsisäisinä neurofibrillisina klustereina, jotka edustavat histologisen diagnoosin perustaa. Taudin etenemisen jälkeen on vakava neuronaalinen häviö, johon liittyy gliosis (neuroglia-solujen, jotka ovat hermosolujen tukirakosta muodostavia soluja, reaktiivinen tai diffuusi proliferaatio). jossa neurofibrillaaristen plakkien ja klustereiden läsnäolo on suurempi.
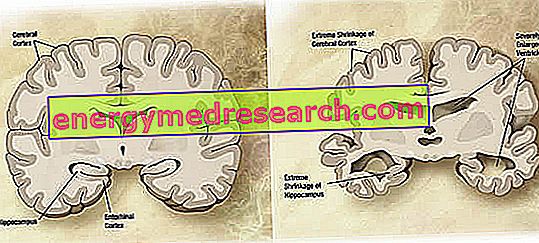
Kuva 1. Aivojen koronaaliosa: AD: n (wikipedia-kuvan lähde) normaalin aivojen ja aivojen väliset erot.
synnyssä
Alzheimerin taudille on tunnusomaista pääasiassa kaksi tyypillistä leesioita: seniloidisten plakkien ekstrasellulaarinen kerääntyminen, jotka koostuvat pääasiassa p-amyloidipeptidistä (Aβ) ja intranuronaalisista neurofibrillaarisista klustereista, jotka muodostuvat hyperfosforyloidusta tau-proteiinista.
- Seniliset plakit löytyvät aivojen alueilta, kuten hippokampukselta, amygdalalta ja neokortexilta.
Ap-peptidi on peräisin amyloidiproteiinin prekursorin (APP) proteolyyttisestä leikkauksesta p-sekretaasin avulla. Tämä leikkaus synnyttää terminaalisen karboksifragmentin, jossa on 99 tähdettä (CTF tai C99), joka sitten leikataan p-sekretaasilla tuottamaan A-fragmentteja, joilla on eri pituudet. On tunnettua, että eniten Aβ-lajia on Ap40-fragmentti. Toinen tunnettu fragmentti, joka on muodostettu proteolyyttisestä leikkauksesta, joka on vähemmän kuin A40, on Aβ42, joka on alttiimpi muodostamaan amyloidifibrilejä, jotka kertyvät Aβ-lajeina yksilön aivoissa, joilla on Alzheimerin tauti.
- Toinen Alzheimerin taudissa läsnä oleva komponentti edustaa neurofibrillisia klustereita, jotka koostuvat hermosolujen läsnäolosta neuronien sytoplasmassa. Neurofibrilliset klusterit ovat liukenemattomia ja näyttävät olevan resistenttejä proteolyysiprosesseille in vivo, jolloin ne jäävät kudososiin jopa pitkään neuronaalisen kuoleman jälkeen. Rakennetta tarkkailemalla fibrillaariset klusterit koostuvat kaksoiskierrefilamenteista ja lineaarisista filamenteista, joilla on samanlainen koostumus. Koostumusta analysoimalla kaksoiskierrejoukot ovat pääosin hyperfosforyloitua tau-proteiinia. Tau on mikroputkiin liittyvä aksonaalinen proteiini, joka helpottaa sen kokoamista.
Muita tärkeitä Alzheimerin taudissa esiintyviä neuropatologisia muutoksia ovat mitokondrioiden toimintahäiriö, hapettava neuronaalinen vaurio, synaptinen häviö ja aksonaalinen degeneraatio.
Neurokemialliset näkökohdat
Kuten jo on selitetty, AP-peptidi, joka on peräisin APP-prekursorin proteolyyttisestä leikkauksesta, edustaa Alzheimerin taudin neurotoksista komponenttia . Erityisesti on oletettu, että AP voi olla tärkeä normaaleille aivotoiminnoille ja jos se voittaa tietyt konsentraatiot, se voi tulla neurotoksiseksi. Lisäksi sekä A: n aggregaatit että erilaiset isoformit voivat vaikuttaa erilaisiin biologisiin, fysiologisiin tai patologisiin rooleihin, määrittää ja osallistua taudin myöhempiin vaiheisiin. On havaittu, että Ap toimii neuromodulaattorina, joka vaikuttaa joidenkin neurotransmitterien vapautumiseen ilmeisten neurotoksisuuden merkkien puuttuessa.
Esimerkiksi Ap: n neuromoduloivalla roolilla fysiologisessa kontekstissa voisi olla tärkeä merkitys neurotransmitterijärjestelmän oikean tasapainon kannalta. On hyvin tunnettua, että tämä järjestelmä koostuu välittäjäaineista, aineista, jotka välittävät informaatiota hermostoa muodostavien solujen, neuronien välillä synaptisella siirrolla.
Patologisissa tiloissa toisaalta Ap-välitteinen synaptinen siirto voisi liittyä neurotransmissioon muuttumiseen ennen neurodegeneratiivisia tapahtumia. Näiden muutosten seurauksena voi syntyä varhaisia kognitiivisia ja ei-kognitiivisia häiriöitä, jotka perustuvat vaikuttaviin neurotransmitterijärjestelmiin ja eri aivojen alueisiin.
Neurotransmitterijärjestelmien muutokset ja signaalinvälitysmekanismi Alzheimerin tautia sairastavien yksilöiden aivoissa ovat hyvin monimutkaisia. Yksi järjestelmistä, jotka näyttävät muuttuvan, koskee kolinergistä signalointijärjestelmää, johon liittyy neurotransmitteri-asetyylikoliini. Itse asiassa on osoitettu, että Alzheimerin tautia sairastavilla henkilöillä on vähentynyt kolinerginen siirto aivokuoren ja hippokampuksen tasolla, tärkeitä aivojen alueita, jotka on omistettu ilmiöille, kuten oppimiselle ja muistille. Tämän neurotransmitterijärjestelmän lisäksi on havaittu muutoksia noradrenergisissä, serotonergisissä sekä glutamaatti- ja GABA-järjestelmissä Alzheimerin taudissa.